环烷烃
此条目需要补充更多来源。 (2011年7月6日) |
环烷
按环的大小,环烷烃可被分为小、中、大三类。环丙烷、环丁烷视作小的。常见的环戊烷、环己烷、环庚烷以及环辛烷至环十三烷是中等大小的,更大的则被视为大的环烷烃。
命名法
[编辑]首先确定其为环烷烃,并观察其有几个碳原子,则命名为环几烃。此后再加上卤素、甲基等取代基的命名。
具多环的环烷烃的命名法
[编辑]除非有俗名,否则具多环的环烷烃如桥环烷烃及螺环烷烃的命名较为复杂。名字包括表示环数量的前缀(如“二环”)、各环内碳原子总数的后缀以及表示各端点之间碳原子数的数字前缀(表示于中括号内。多个环公用的碳原子,即桥头碳不计入内)。
- 例子一:
这个环烷总碳数为七,由一个五元环及一个四元环,共两个环组成,故词尾为“庚烷”,词头为“二环”。两个被共用的碳原子间有三个连接路线:一为五元环的部分,共三个碳(两个桥头碳不计入内,下同);二为四元环的部分,共二个碳;三为两环之间共用的边线,只由两桥头碳直接连结,中间没有碳。由此得出中括号内的数字(以降序表示数字之间用点分隔),[3.2.0]。故上图的环烷名为二环[3.2.0]庚烷,而数字的个数总比环数多一个(在此有两个环及三个数字)。“[3.2.0]二环庚烷”亦可接受,但环上有取代基时“二环[3.2.0]庚烷”有保留前面的位置的好处,方便加上“2,3-二氯”或“3,3-二甲基”等含数字的前缀,以符合IUPAC命名常规。
- 例子二:
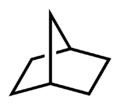 二环[2.2.1]庚烷(俗名降冰片烷)
二环[2.2.1]庚烷(俗名降冰片烷)
上图环烷总碳数为七,全为单键,词尾为庚烷;两共用碳间有两对二碳碳链,也被一个碳原子连接着,故词尾之前的数字前缀为[2.2.1](共用碳不计入内);这个环烷由两个环组成,故前缀为“二环”,最后得出“二环[2.2.1]庚烷”。
物理性质
[编辑]| 烷烃 | 化学式 | 沸点(°C) | 熔点(°C) | 液体密度(g·cm−3)(20 °C) |
| 环丙烷 | C3H6 | −33 | −128 | |
| 环丁烷 | C4H8 | 12.5 | −91 | 0.720 |
| 环戊烷 | C5H10 | 49.2 | −93.9 | 0.751 |
| 环己烷 | C6H12 | 80.7 | 6.5 | 0.778 |
| 环庚烷 | C7H14 | 118.4 | −12 | 0.811 |
| 环辛烷 | C8H16 | 149 | 14.6 | 0.834 |
| 环壬烷 | C9H18 | 169 | 10-11 | 0.8534 |
| 环癸烷 | C10H20 | 201 | 9-10 | 0.871 |
| 环十一烷 | C11H22 | |||
| 环十二烷 | C12H24 | 247.0 | 60.4 | |
| 环十三烷 | C13H26 | 23.5 | ||
| 环十四烷 | C14H28 | |||
| 环十五烷 | C15H30 | |||
| 环十六烷 | C16H32 | |||
| 环十七烷 | C17H34 | 66.0-66.2 | ||
| 环十八烷 | C18H36 | |||
| 环十九烷 | C19H38 | |||
| 环二十烷 | C20H40 |
就物理性质而言,环烷烃与链状烷烃相似。不过,因为环状结构增加分子间的接触面,增强色散力(London dispersion force),环烷烃的沸点、熔点和密度比同碳原子数的烷烃较高。
环烷烃的角张力
[编辑]sp3 杂化的环烷烃碳原子与理想的角键(109°28')有所偏差,增加了分子的势能,降低稳定性。重叠构状(eclipsed,参见构象异构)的氢原子也会降低环烷烃的稳定性。 环烷烃的几何结构令其分子势能增加,“角张力能”(strain energy)是这种增幅的理论数值,以平均键能及环烷烃的标准燃烧焓变的实验值计算出来。
具有六十度 C-C-C角的三角形环丙烷的角张力最强,亦有三对重叠氢原子,比丙烷活跃,角张力的计算值约为 120 kJ/mol。 正方形的环丁烷具折叠状,减少重叠氢原子间的相互作用,令角张力稍低,但 C-C-C角仍接近九十度,所以角张力颇高,为110 kJ/mol.
假如环戊烷五颗碳原子是共面的话,其C-C-C角会是108度,和甲烷的正四面体H-C-H角极近。现实中的环戊烷成折叠状,但对键角只有轻微影响,其引起的角张力相对较小。 折叠亦减少重叠氢原子间的相互作用,令角张力只有大约25 kJ/mol.
环己烷 六元环的折叠允许碳原子得到理想的正四面体碳键角(109°28'),使其重叠氢原子间的相互作用及角张力小得可以忽略,这发生在最稳定的椅型环己烷之上。椅型环己烷上各对相邻碳原子的轴向氢都指向相反方向,将重叠氢原子间的相互作用几乎完全消除。
比环己烷大的环烷烃没法得到没有角张力的结构,所以角张力能比环己烷高,以九碳环最高(约为50 kJ/mol)。在此以后,角张力能缓慢下降,从十一至十二碳环跌幅较为显著。下一显著跌幅发生在十四碳环,角张力能在10 kJ/mol的水平。对于十四碳环以后的角张力具争议性,有除著碳环原子数缓缓上升的说法,也有角张力完全消失的说法。一般来说,角张力和氢原子间的相互作用只在碳原子数较小的状况下才有重要影响。
反应
[编辑]由于只有强的碳-碳键及碳-氢键,环较大,角张力弱的环烷烃十分稳定,如非环状烷烃一般,能进行反应也和链状烷烃相似,如燃烧及自由基取代反应。 环较小的环烷烃(尤其是环丙烷)受角张力(ring strain)影响(见拜耳张力学说),稳定性较低。虽然没允许亲电加成反应反应的不饱和双键,但反应和烯烃相似,因为它们能透过开环或断环进行亲核取代反应。 环烷烃可由氢化从狄耳士-阿德尔反应制得的同碳原子数环烯烃制得。
常用的环烷烃
[编辑]- 甲基环己烷 - 现今修正液的主要溶剂,毒性比早期使用的1,1,1-三氯乙烷为低,亦不会破坏臭氧层。
参见
[编辑]注释
[编辑]
参考资料
[编辑]- 国际纯化学和应用化学联合会,化学术语概略,第二版。(金皮书)(1997)。在线校正版: (1995) "Cycloalkanes"。doi:10.1351/goldbook.C01497
- Organic Chemistry IUPAC Nomenclature. Rule A-23. Hydrogenated Compounds from Fused Polycyclic Hydrocarbons http://www.acdlabs.com/iupac/nomenclature/79/r79_73.htm (页面存档备份,存于互联网档案馆)
- Organic Chemistry IUPAC Nomenclature.Rule A-31. Bridged Hydrocarbons: Bicyclic Systems. http://www.acdlabs.com/iupac/nomenclature/79/r79_163.htm (页面存档备份,存于互联网档案馆)
- Organic Chemistry IUPAC Nomenclature.Rules A-41, A-42: Spiro Hydrocarbons http://www.acdlabs.com/iupac/nomenclature/79/r79_196.htm (页面存档备份,存于互联网档案馆)
- Organic Chemistry IUPAC Nomenclature.Rules A-51, A-52, A-53, A-54:Hydrocarbon Ring Assemblies http://www.acdlabs.com/iupac/nomenclature/79/r79_158.htm (页面存档备份,存于互联网档案馆)
外部链接
[编辑]- "Cycloalkanes" (页面存档备份,存于互联网档案馆) at the online Encyclopædia Britannica
- "Cycloalkanes"[永久失效链接] by the Chemistry staff at Westminster College
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||
|


